



2023年2月2日,中国医学科学院基础医学研究所黄波团队在Science Translational Medicine《科学转化医学》发表题为“Epigenetic modification of CSDE1 locus dictates immune recognition of nascent tumorigenic cells”(CSDE1的表观遗传修饰决定了新生肿瘤细胞的免疫识别)的研究论文,诠释了原始肿瘤细胞逃避免疫攻击的过程,并从源头部分解释人为什么得肿瘤,又如何不得肿瘤背后的机制。
肿瘤发生是基因突变的结果。然而,DNA突变却是一个正常的生理现象,其在正常人体细胞中高频出现。DNA突变作为一种随机事件,在绝大多数情况下,其会导致细胞死亡或不产生显著影响;但是极少数情况下,DNA突变将导致细胞转化成为肿瘤细胞。尽管DNA突变导致正常细胞恶性转化的几率非常低,但由于机体细胞数量极其巨大,使得机体出现肿瘤细胞成为一个不可避免的结局,并在个体中普遍存在。尽管如此,出现这些肿瘤细胞并不等同于得肿瘤。在人群中,只有极少数个体的肿瘤细胞最终发展成为有临床症状的肿瘤,即我们常说的“得了肿瘤”。那么,同样是恶性转化的肿瘤细胞,为什么出现“长肿瘤”亦或“不长肿瘤”的不同结局?这其中一个重要原因是机体存在强大的免疫监视,特别与一类称之为CD8+ T细胞的关键免疫细胞相关,其识别肿瘤细胞表面的肿瘤抗原并进而将肿瘤细胞杀灭。然而,总有少数肿瘤细胞能够逃避CD8+ T细胞的识别和杀伤,特别是突变所致的肿瘤细胞在最初形成之际,该初始肿瘤细胞面临免疫监视抑或逃逸监视的选择,从而决定肿瘤的最终命运,因此,阐明该事件背后的机制是肿瘤免疫研究的核心问题,但却一直是一个谜团,这主要归结于缺乏相应的肿瘤模型(一个肿瘤细胞长出一个肿瘤)和手段。
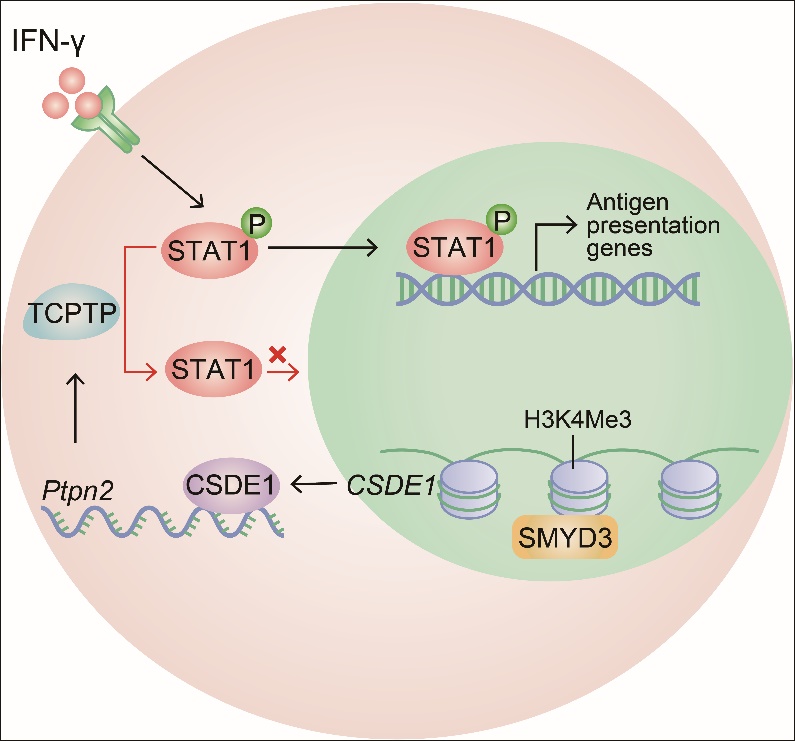
肿瘤种子细胞,亦称为肿瘤干细胞,是非常少的一群具有自我更新能力的关键肿瘤细胞,具有极强的成瘤性,是肿瘤发生的根源。本研究团队前期利用生物机械力学的原理,建立了软的三维纤维蛋白凝胶(Soft 3D fibrin gel)培养系统,能够在体外筛选、扩增肿瘤种子细胞,而在体内接种 5个细胞即可在免疫正常的小鼠体内成瘤。在本研究中,该团队成功地接种一个肿瘤种子细胞,使其能够在免疫正常小鼠体内长出肿瘤。利用该手段,团队发现单个肿瘤种子细胞,尽管在免疫缺陷的小鼠均可成瘤,但在免疫正常的小鼠体内只有一部分成瘤,一部分不成瘤。这表明肿瘤种子细胞成瘤的能力相似,但受免疫识别和监视的特性却存在差别。研究还发现,这些最终能发展成为肿瘤的种子细胞均高表达一种称之为CSDE1的RNA结合蛋白。进一步的分子机制探究揭示,原始的肿瘤种子细胞在早期扩增阶段,受微环境的生物机械力的作用,出现了表观遗传修饰的差异,导致一部分肿瘤种子细胞高表达CSDE1,而另一部分则低表达该蛋白;CSDE1通过稳定一种磷酸水解酶PTPN2的mRNA而上调其表达,PTPN2识别磷酸化的酪氨酸位点,从而使STAT1去磷酸化而失活。活化的STAT1是启动抗肿瘤免疫的关键信号,其能够使肿瘤细胞高表达肿瘤抗原,促进CD8+ T细胞识别和杀伤。因此,一旦STAT1分子失活,肿瘤种子细胞获得了肿瘤免疫逃逸的表型,进而逃避免疫攻击,最终发展成为具有临床症状的肿瘤。
本团队利用单一肿瘤细胞成瘤模型,模拟肿瘤发生极早期其原始肿瘤细胞与免疫互作过程,揭示出肿瘤免疫逃逸的新机制,为目前临床肿瘤免疫治疗后复发,提供新的理论基础和研究方法,为发展下一代肿瘤免疫治疗提供了潜在策略。
本研究工作得到了国家自然科学基金(81788101)、中国医学科学院医学与健康科技创新工程项目(2021-I2M-1-021)等项目的资助。中国医学科学院基础医学研究所黄波教授为通讯作者,助理研究员吕家迪和博士后周雅博为论文的共同第一作者。
原文链接:https://www.science.org/doi/10.1126/scitranslmed.abq6024