Nat Commun丨黄波团队在破解T细胞和T细胞白血病免受穿孔素攻击的机制上取得新进展
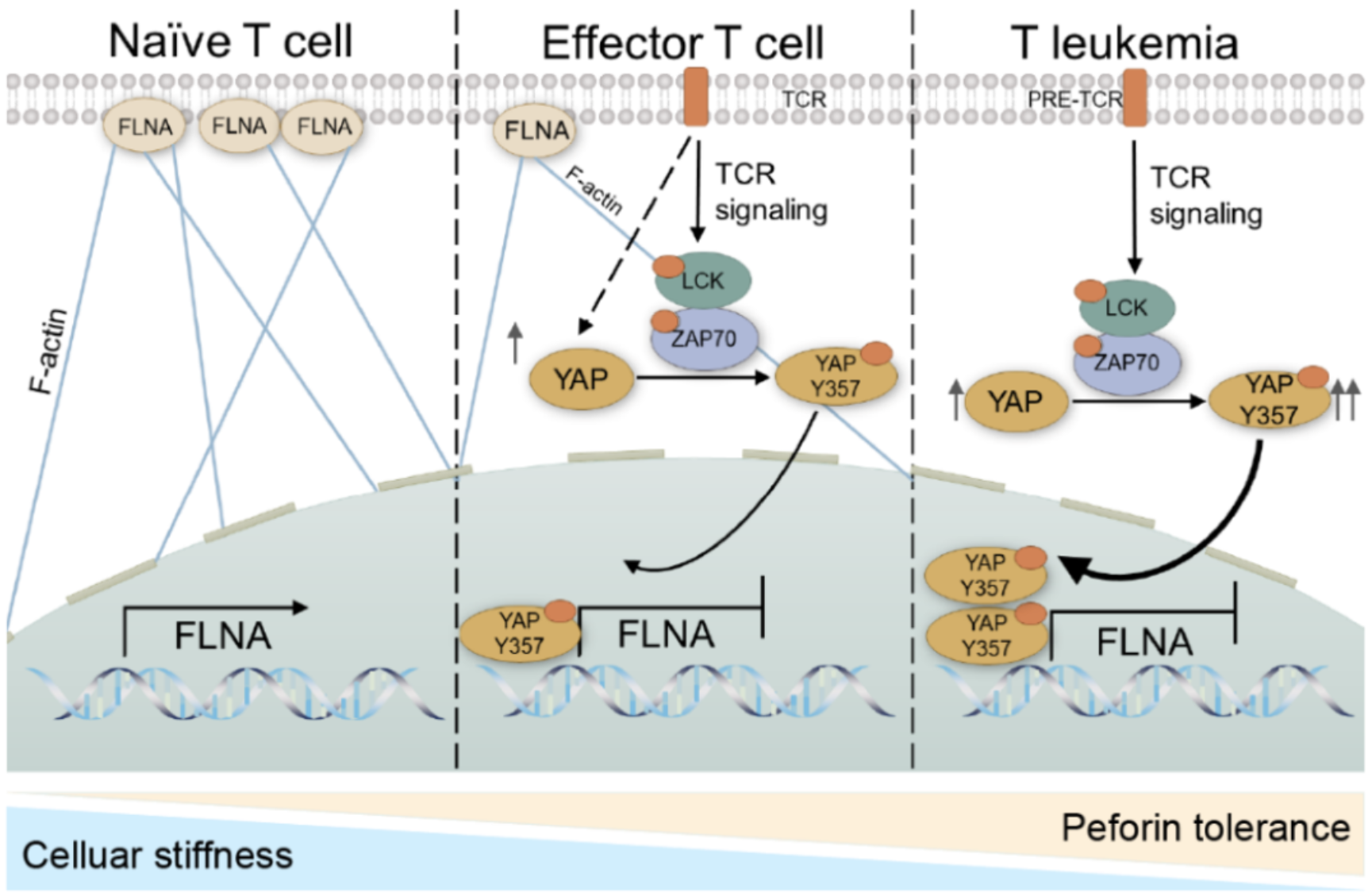
在人体免疫系统中,CD8+细胞毒性T细胞(CTLs)是对抗肿瘤细胞的重要力量。CTLs通过与目标肿瘤细胞之间形成免疫突触,从而释放穿孔素和促凋亡蛋白酶granzymes。穿孔素随后在肿瘤细胞膜上形成孔洞,允许granzymes进入细胞触发肿瘤细胞凋亡。令人费解的是,穿孔素在杀伤肿瘤细胞的过程中并不会在CTLs的细胞膜上形成孔洞【1】,这一现象提示穿孔素成孔似乎是一种单向作用,并不会破坏自体T细胞。因此,阐明穿孔素内在作用机理对于CTLs介导的肿瘤免疫研究尤为重要。 北京时间2024年2月15日,中国医学科学院基础医学研究所黄波教授团队联合北京大学人民医院的张晓辉教授团队在Nature Communications上发表了题为Cell softness renders cytotoxic T lymphocytes and T leukemic cells resistant to perforin-mediated killing 的研究成果。这项研究揭示了T细胞和T细胞白血病细胞通过调节其细胞柔软性来抵抗穿孔素介导的杀伤,这一发现不仅为癌症治疗提供了新的靶点,也为T细胞免疫治疗开辟了新的研究方向。 成人T细胞白血病的发病率约占成人急性淋巴细胞白血病的25%,恶性程度高,预后较差,现阶段靶向药物少,常用的广谱化疗药物疗效差,药物不良反应多[2]。目前,对于其病因及发病机制并未完全明确,但病毒感染与T-ALL发生相关性已得到证实,人类T淋巴细胞白血病病毒 (HTLV-1) 的感染与T-ALL的发生密切相关,是第一个被发现的可诱发人白血病的反转录病毒【3】。病毒感染导致未成熟T细胞在骨髓和 (或) 淋巴组织中增殖活化失调,引起TCR信号异常激活,从而引起恶性增殖。因此推测:恶性转化的T细胞可能继承正常T细胞对于穿孔素抵抗的能力,这一能力的获取有助于T细胞白血病免疫逃逸的发生,从而避免CTL杀伤并有利于疾病恶性发展。 黄波团队长期从事生物机械力学与肿瘤免疫学前沿交叉研究,之前使用3D纤维蛋白凝胶培养系统和原子力显微镜发现肿瘤干性细胞具有柔软性这一特性,并且发现肿瘤干性细胞可以利用这一特性有效阻止穿孔素在细胞膜上成孔【4,5】。因此推测T细胞和T细胞白血病细胞是否同样利用生物机械力学机制抵抗了穿孔素的杀伤? 在这项最新研究中,黄波团队首先通过膜蛋白CRISPRa筛选文库和MAGeCK算法,筛选出关键基因:细胞骨架蛋白filamin A(FLNA)。FLNA维持细胞机械硬度,而细胞通过降低FLNA的表达,变得更软,从而增加了对穿孔素的抵抗力。这一机制不仅适用于正常的CTLs,也适用于恶性的T细胞,揭示了T白血病拥有一条独特的免疫逃逸路径。 黄波团队进一步发现,Yes-associated protein(YAP)是调控FLNA表达的关键因素。YAP在T细胞受体(TCR)信号激活后上调,进而下调FLNA的表达,这一过程对于T细胞和T细胞白血病细胞的穿孔素抵抗至关重要。重要的是,YAP1一直被认为通过其丝氨酸磷酸化而进行调控;黄波团队还首次发现TCR的下游信号分子ZAP70/LCK能够与YAP1直接结合,通过酪氨酸磷酸化激活YAP1,使得YAP1入核,这很好地解释了T细胞激活后,YAP分子会迅速活化进而下调FLNA的表达,从而降低效应性T细胞的软硬度。同时黄波团队也发现T细胞白血病有更高水平的TCR激活信号,从而酪氨酸磷酸化YAP使其拥有更加柔软的特性。 这项研究不仅提供了对T细胞如何在免疫突触处避免自我裂解的新见解,也为开发针对T细胞白血病的治疗策略提供了新的方向。通过靶向YAP或FLNA,可能能够同时攻击白血病细胞并增强CTLs的杀伤效能,为癌症治疗带来双重利好。 中国医学科学院基础医学研究所黄波教授和北京大学人民医院的张晓辉教授为论文共同通讯作者,博士后周雅博和博士生王殿恒为论文共同第一作者。
原文链接:
https://www.nature.com/articles/s41467-024-45750-w