



肿瘤细胞发生耐药是癌症治疗失败的主要原因。目前临床所使用的化疗药物均可诱导肿瘤细胞耐药,导致肿瘤复发、转移和患者的最终死亡。然而,迄今为止肿瘤耐药的真正机制仍不清楚。
能量分子ATP的不断产生是细胞存活的根本。能量是守恒的,既不能增加新的能量,也不能消灭旧的能量,但能量可以转移。细胞内ATP生成是电子传递过程中,将能量释放转移给ADP和无机磷酸的过程。然而,电子传递的过程必然伴随着电子的泄露,其直接与氧分子结合,产生有害的氧自由基分子,或称为活性氧(ROS)。ATP分子生成使细胞存活,但ROS产生则可使细胞死亡,肿瘤细胞也不过是一种细胞,过高的ROS同样诱导其死亡。
化疗药物是一类特定的分子,通常能够与细胞核的DNA分子相互作用。但是,如果将其空间构象改变,药物分子就失去与DNA结合能力,此即为药物分子的解毒。细胞通常利用一类称之为P450的单加氧酶对药物分子进行氧化,即药物分子RH氧化为ROH,这样导致药物分子的构象改变,即完成对药物分子的解毒。然而这种分子构象的变化,是以消耗能量ATP为代价的,必然伴随ROS的大量产生。肿瘤细胞如具有强大清除ROS的能力,即可形成所谓的耐药。
细胞内ROS主要以H2O2的形式存在,而对其的清除则主要依赖NADPH分子。2个NADPH提供2个氢原子给H2O2,生成2分子的H2O,即清除了自由基。这样一种清除自由基的方式既简便又清洁,然而NADPH的生成却大费周章。这主要是NADPH的生成受到糖原代谢的调控,糖原分解产生的6-磷酸葡萄糖流向磷酸戊糖代谢途径,从而生成NADPH。
2023年12月15日,中国医学科学院基础医学研究所黄波团队在 Journal of Clinical Investigation 期刊上发表了题为:AhR sulfenylation promotes glycogenolysis and rescues cancer chemoresistance 的研究论文,针对化疗药物诱导的活性氧(ROS),阐明肿瘤细胞如何通过启动糖原代谢通路,以增强ROS清除的分子机制,从而揭示肿瘤耐药的根本性原因。

在这项研究中,黄波团队发现,转录因子芳香烃受体(AhR)可以作为细胞内感应ROS水平变化的感受器,ROS水平升高时,AhR第300位点的半胱氨酸(C300)游离的巯基发生亚磺酸化修饰(SH变成S-OH)。随后,被修饰的AhR从HSP90复合物中解离,并被招募到糖原靶向蛋白(protein targeting to glycogen,PTG)上,通过竞争性结合蛋白磷酸化酶(phosphoprotein phosphatase1,PP1)位点,抑制了糖原磷酸化酶(PYGL)的去磷酸化,促进了糖原分解。糖原分解来源的6-磷酸葡萄糖(G6P)流向磷酸戊糖途径(pentose phosphate pathway,PPP)产生的NADPH清除P450s代谢化疗药物产生的ROS,从而使得肿瘤细胞逃避氧化应激致死性攻击,进而诱发肿瘤患者的耐药。
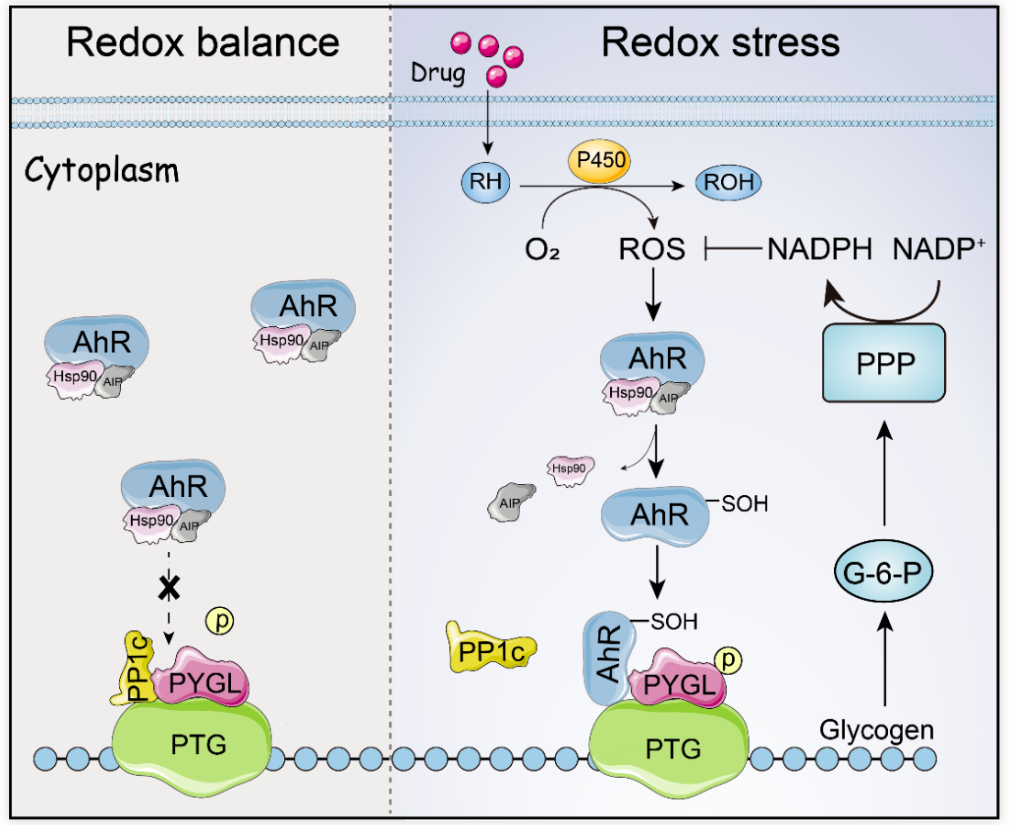
AhR作为肿瘤代谢/免疫中的一个关键分子,针对AhR的多个抑制剂正在进行临床试验。这项研究工作对于AhR导致肿瘤化疗耐药关键机制的阐明,具有重要理论意义和临床价值。
该研究受到了国家自然科学基金(81788201)、中国医学科学院医学与健康科技创新工程(2021-I2M-1-021)、国家重点研发计划(2022YFA1206000)等项目的支持。
(本文转载自生物世界)