NI:老药新用!黄波团队发现这种情绪稳定剂通过靶向乳酸代谢激活抗肿瘤免疫
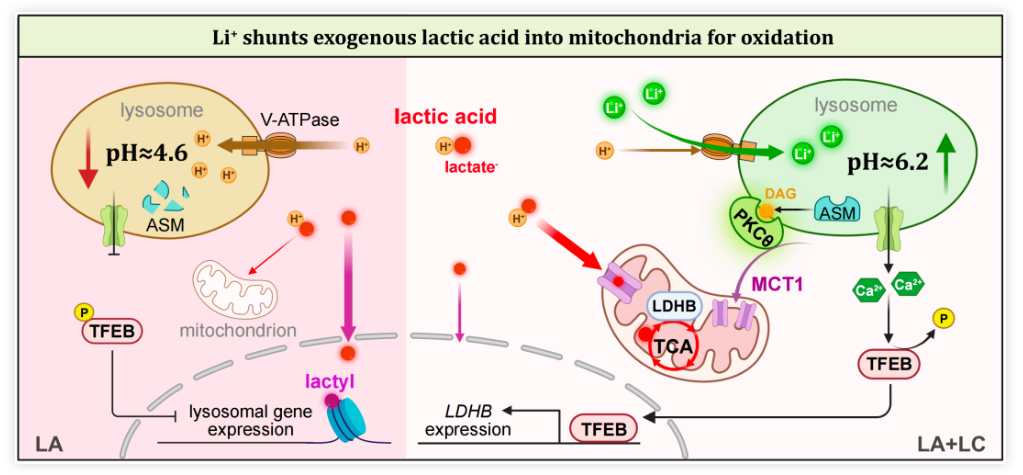
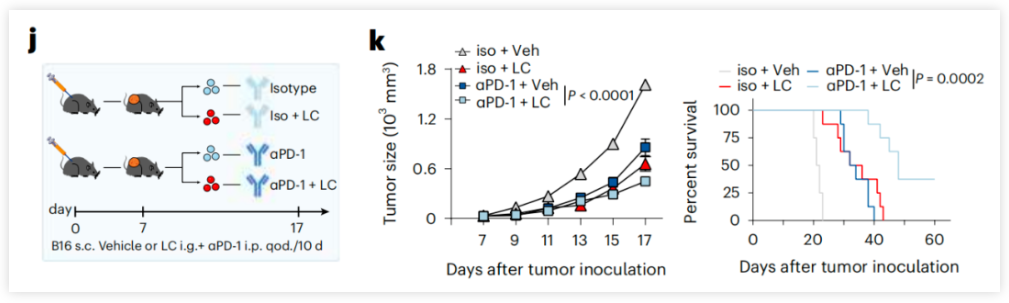
人类肿瘤细胞产生的乳酸(lactic acid,LA)比正常细胞多40倍,肿瘤微环境中存在高达40μmol/g的乳酸。因此,肿瘤浸润淋巴细胞(TIL)被认为“浸泡”在富含乳酸的液体中,其中乳酸被输送到TIL的细胞质中,并通过大部分未知的机制导致TIL难以有效杀伤肿瘤细胞。 然而,较高的pH值(即较少的H+浓度)有利于糖酵解酶发挥其活性,这可能部分解释了乳酸介导的抑制。在临床上,高浓度的乳酸与癌症患者的不良预后相关。 这些发现共同表明,乳酸是肿瘤微环境中潜在的免疫检查点分子。然而,乳酸本身也是一种能量来源,可以通过乳酸循环(也叫做科里循环)或直接在线粒体内氧化,产生能量。乳酸是否以及如何作为碳源来激活肿瘤反应性CD8+T细胞,尚不清楚。 2024年1月23日,华中科技大学同济医学院、中国医学科学院黄波教授团队在 Nature Immunology 期刊发表了题为:Lithium carbonate revitalizes tumor-reactive CD8+ T cells by shunting lactic acid into mitochondria 的研究论文。 该研究表明,碳酸锂(LC)通过将乳酸(LA)转运到线粒体中来激活肿瘤反应性CD8+ T细胞,因此,使用碳酸锂靶向乳酸代谢,可以支持癌症免疫治疗。 乳酸(LA)通过单羧酸转运体信号系统从肿瘤细胞稳定流入细胞外空间,抑制抗肿瘤T细胞免疫。然而,乳酸也是一种天然的能量代谢物,可以在线粒体内氧化,并可能刺激T细胞。 在这项最新研究中,研究团队发现,降低乳酸水平的碳酸锂(LC,一种情绪稳定剂,可用于治疗狂躁症、双相情感障碍、抑郁症等精神疾病)可以逆转乳酸介导的CD8+T细胞免疫抑制。胞质中的乳酸增加了质子泵入溶酶体。碳酸锂(LC)干扰V-ATPase(作为质子泵维持溶酶体pH),阻止溶酶体酸化,并挽救溶酶体二酰甘油-PKCθ信号通路,促进单羧酸转运体1(MCT1)定位到线粒体膜,从而将乳酸转运到线粒体中作为CD8+T细胞的能量来源。 接下来,研究团队在多种肿瘤小鼠模型上进行了实验,以验证碳酸锂(LC,化学式为Li2CO3)是否能够在体内改善基于T细胞的癌症免疫治疗。结果显示,对肿瘤小鼠模型进行75mg/kg体重剂量(碳酸锂的临床等效剂量)进行每2天一次的治疗,碳酸锂(LC)治疗抑制了肿瘤生长并延长了小鼠生存期,而氯化锂(LiCl)治疗具有中等的抗肿瘤效果,氯化钠(NaCl)没有产生治疗效果,碳酸钠(Na2CO3)仅略微抑制了肿瘤生长,但没有延长生存期。 这些结果表明,碳酸锂通过促进体内乳酸氧化来增强CD8+T细胞抗肿瘤免疫。此外,碳酸锂和PD-1单抗联合使用,带来了更强的肿瘤生长抑制和更长的生存期。 接下来,乳酸抑制了来自人类健康供体外周血的抗CD3/CD28刺激的CD8+T细胞的激活,而添加碳酸锂可逆转这一抑制效果。 该研究还收集了结肠癌(n=14)和乳腺癌(n=6)患者的肿瘤组织,发现肿瘤组织中乳酸的浓度增加,并且碳酸锂治疗改善了肿瘤浸润CD8+T细胞活性,这些结果表明,碳酸锂通过肿瘤浸润淋巴细胞(TIL)依赖性和乳酸依赖性机制发挥抗肿瘤作用。 此外,该研究还使用碳酸锂治疗了免疫系统人源化的黑色素瘤小鼠模型,结果显示,治疗导致了肿瘤组织、血液和脾脏中人CD8+T细胞的比例增加,同时抑制了肿瘤生长。这些结果表明,LC治疗可以改善基于T细胞的肿瘤免疫治疗,并有可能应用于人类癌症患者。 综上所述,该研究证明了肿瘤微环境中的乳酸会抑制肿瘤反应性CD8+T细胞的活性。而碳酸锂通过干扰V-ATPase和阻断溶酶体酸化,导致乳酸转运到线粒体进行氧化,不仅缓解了对CD8+T细胞的抑制,还增强了CD8+T细胞的抗肿瘤免疫。 目前,靶向乳酸代谢正在成为一种潜在的抗肿瘤治疗选择,靶向MCT1以减少乳酸的摄取或靶向LDHA以阻止乳酸的生成,是当前的主要策略,但这两种方式不可避免地会影响正常组织的生理功能。而该研究提出的使用碳酸锂直接降低乳酸水平的替代方法,是一种有潜力的激活基于T细胞的抗肿瘤免疫的新策略。
(本文转载自生物世界)